Il collirio della Montalcini potrebbe essere presto disponibile al grande pubblico. Il farmaco si chiama così perché è derivato dalla versione ricombinante del Nerve growth factor (Ngf), il fattore di crescita delle cellule nervose la cui scoperta, nel 1986, valse a Rita Levi-Montalcini il premio Nobel per la medicina. Si tratta di un medicinale utile per il trattamento della cheratite neutrofica moderata o grave, per la quale non esistevano a oggi cure efficaci.
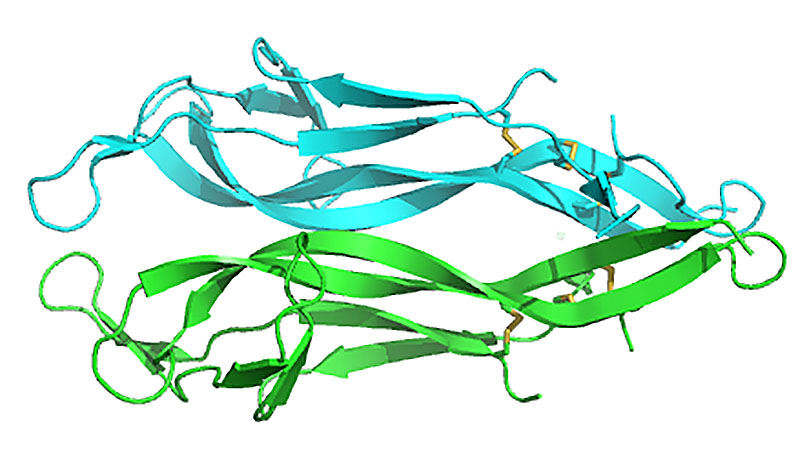
Struttura del Ngf (fattore di crescita nervoso): il farmaco sviluppato da Dompè è ottenuto dalla versione ricombinante del Ngf, una piccola proteina segnale coinvolta nello sviluppo del sistema nervoso nei vertebrati composta da due unità di 118 aminoacidi.
Rita Levi-Montalcini individuò per prima le proprietà rigenerative e riparatrici e del Ngf, proteina prodotta naturalmente dal corpo umano e deputata alla conservazione e alla sopravvivenza delle cellule nervose, e da quel momento l’Ngf non ha mai smesso di attrarre l’interesse e la curiosità della ricerca farmaceutica. Dimostratosi utile nello specifico in campo oftalmico, la sfida è stata quella di sintetizzarlo e produrlo nella sua versione ricombinante, grazie a tecniche di laboratorio che consentono di mettere insieme materiale genetico di diversa provenienza.
Già nel 2011 e nel 2014, l’azienda biofarmaceutica Dompè – che ha sviluppato il farmaco – aveva avviato due sperimentazioni per testare l’efficacia del Ngf su pazienti con problemi oftalmici, sviluppando su scala industriale presso l’impianto biotecnologico dell’Aquila un processo idoneo a produrre Ngf ricombinante. Un impegno che oggi ha portato alla realizzazione del farmaco (cenegermin gocce oculari), il primo trattamento biotecnologico efficace contro la cheratite neutrofica: una malattia rara che può portare alla cecità e per la quale non esistevano ancora trattamenti adeguati. In futuro però, potrebbe essere utilizzato anche per malattie oftalmologiche più diffuse, come la retinite pigmentosa. Si tratta del primo farmaco orfano – ovvero destinato alla cura di una patologia rara – autorizzato al mondo per questo tipo di malattia, che grazie alla sua composizione, agisce ripristinando i normali processi di guarigione dell’occhio e riparando il danno corneale.

Rita Levi-Montalcini (Torino, 22 aprile 1909 – Roma, 30 dicembre 2012) è stata una neurologa e senatrice a vita italiana, Premio Nobel per la medicina nel 1986.
Con una procedura accelerata, iniziata nel novembre 2016 e conclusasi di recente, in virtù della gravità della patologia e della mancanza di alternative valide, il Chmp – parte dell’Ema, l’agenzia europea del farmaco – ha dato il proprio parere positivo al medicinale, cui è seguita anche l’autorizzazione definitiva della Commissione Europea all’immissione in commercio. Il farmaco sta ora seguendo il percorso di registrazione negli Stati Uniti, alla Food and drug administration, mentre in Giappone è in corso il dialogo con la Pharmaceuticals and medical device agency.
(Testo aggiornato e corretto il 28 luglio 2017)
![]()
Dalla collana “Alle frontiere della salute”:
- Il neuroscienziato Giacomo Rizzolatti svela il mistero dei neuroni specchio e il rapporto tra cervello umano, arte e comportamenti positivi
- Dalle stelle alle terme: quando i russi atterravano a Cervia per riabilitarsi
- Il modello Morgagni di Forlì, ospedale cablato e niente barelle
- In arrivo il collirio della Montalcini
- È realtà la “scatola magica” che scova i piccoli tumori
- Alleati, battiamo le leucemie. Parla il “pioniere” Masera: più di 80 su 100 oggi ce la fanno
- Primo impianto di retina artificiale eseguito in Italia








